2022 Augustus examen
Lector: A. Kinnaes, open vragen en oefeningen, 2u20 (wij kregen 3uur (+30% extra tijd))
-----------------------------------------------------------------------------------------------------------------------------------------------
Theorie (50%)
Vraag 1 (2 punten)
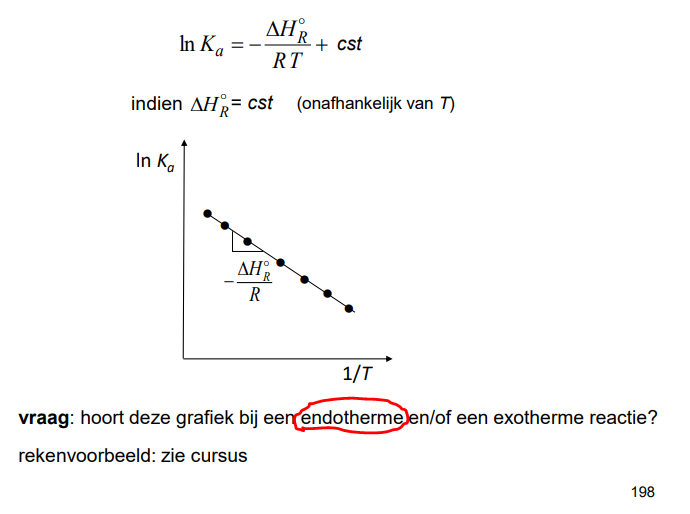
Gegeven de van 't Hoff vergelijking (zie formularium), geef de grafiek voor een endotherme reactie waaruit je de enthalpie kan halen en zeg hoe?
Alles staat op de dia hieronder
Vraag 2 (3 punten)
Leg uit met vergelijking (zie formularium) waarom voor een zuiver stof 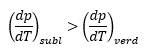
Het zijn de vergelijkingen die onder "Thermodynamica>fase-evenwichten" staan op het formularium Clapeyron/ Clausius-Clapeyron vergelijking.
Vraag 3 (5 punten)
- Leid onder differentiaal vorm de Gibbs-energie af bij isobare omstandigheden, vertrekkende van de definitie voor Gibbs-energie G = H - T.S, gebruik het verband tussen de enthalpie en de inwendige energie en de eerste en tweede hoofdwet van de thermodynamica?
- Wat gebeurt er met de Gibbs-energie als de temperatuur stijgt?
- ???
Puntje 1 was de verwoording wel wat anders en mss dat ik wat vergeten ben en puntje 3 weet ik niet meer wat de vraag was, maar ben vrij zeker dat er 3 deelvragen waren. Puntje 2 ben ik wel zeker.
Oefeningen (50%)
Vraag 1 ( 5 punten)
Thermodynamica
Er werd gegeven dat je stikstofgas had met M=28 g/mol en een druk van 1,0 atm en een temperatuur van 298K, het volume werd verdubbeld. Bereken de entropie bij:
- Reversibele isotherme expansie
- Irreversibele isotherme expansie
- Reversibele adiabatische expansie
- Irreversibele adiabatische expansie
Als ik het goed heb stond er bij 1 van de 2 of beide adiabtische expansies nog iets bij over dat de einddruk niet de begindruk was, maar 0,5 atm maar weet niet meer zeker. Kan zijn dat ik bij de gegevens ook iets ben vergeten, maar denk van niet.
Vraag 2 (5 punten)
Kinetica
Gegeven: Reactie 2A->B
| t (min.) | 0 | 10 | 20 | 30 | 40 | ∞ |
| cB | 0 | 0,089 | 0,153 | 0,200 | 0,230 | 0,312 |
- Aantonen dat het 1ste orde reactie is en k berekenen.
- Concentratie berekenen bij bepaalde tijd (0,4u.)